Pharma- und Biotechunternehmen führen Prozesstransfers aus verschiedensten Gründen durch: Sei es der Bedarf einer Back-Up-Strategie zur Sicherstellung einer angemessenen Marktversorgung der Patienten oder um Herausforderungen, wie einen Mangel an Ressourcen oder Kapazitäten im Bereich der Prozessoptimierung, der kommerziellen Produktion, in der Sekundärverpackung und/oder im Bereich der Supply Chain zu meistern. Auch der Bedarf an größeren Chargen kann einen Prozesstransfer im Rahmen eines Scale-up Projekts erfordern.

Der richtige Projektstart
Aus regulatorischer Sicht unterscheidet sich der Transfer eines aseptischen Herstellungsprozesses zwischen Reinräumen hinsichtlich Zeit und Aufwand nicht wesentlich von dessen ursprünglicher Entwicklung und Implementierung. Er wird jedoch von multivariablen Aspekten, wie z.B. Zulassungsstrategien oder speziellen Behördenvereinbarungen beeinflusst. Zudem müssen die Projektbeteiligten bereit sein, betriebliche und methodische Änderungen umzusetzen, um modernste Prozesse zu etablieren.
Angesichts des hohen Grades an Komplexität ist es von entscheidender Bedeutung das Projekt von Beginn an ganzheitlich zu planen. Ein erster Schritt ist die Bildung eines dedizierten Transferteams, bestehend aus Experten der Bereiche Projektmanagement, Entwicklung, Produktion, Qualitätssicherung, Regulatory Affairs, Qualitätskontrolle sowie Qualifizierung/Validierung. Gemeinsam verantwortet das Team die Initiierung und Etablierung der durchzuführenden Prozesse und Maßnahmen.
Da an Technologietransfers zumeist verschiedene Partner und Standorte beteiligt sind, gilt es zahlreiche Entwicklungsschritte und Herausforderungen zu meistern. Dazu gehören der ursprüngliche Standort bzw. der ‚Sender‘, von dem ein bestimmtes Produkt, Verfahren oder eine Methode übertragen werden soll - und der Zielstandort bzw. der ‚Empfänger‘, zu den eben dieses Produkt, Verfahren oder Methode übertragen wird.
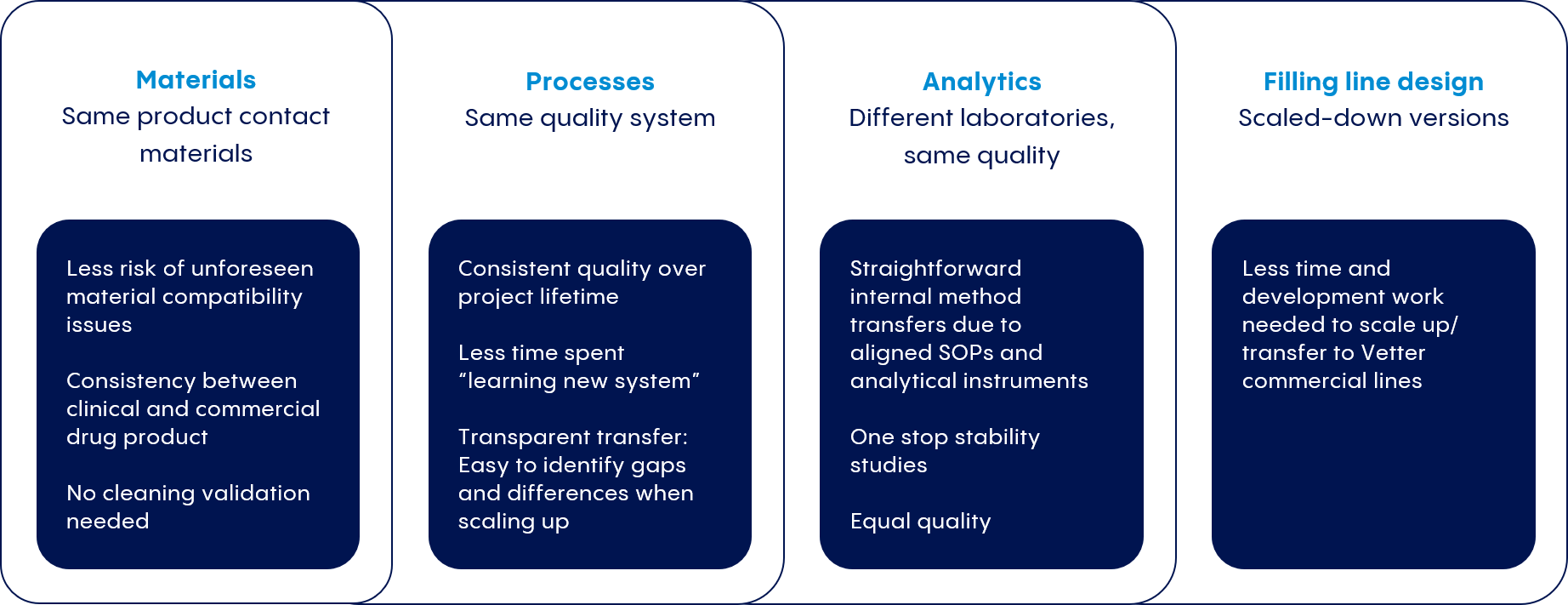
Wir arbeiten eng mit unseren Kunden zusammen, um Prozesse zu entwickeln, die denen unserer kommerziellen Produktionsanlagen entsprechen. So können wir Zeitpläne und Kostenprognosen einhalten, und die Befolgung der behördlichen Vorschriften sicherstellen.
Henrik Oberle, Vice President Development Service
Prozesstransfers basieren auf dem Validierungsansatz der Guidance for Industry der US-amerikanischen Food and Drug Administration (FDA): Process Validation: General Principles and Practice. Die darin aufgeführten Schritte gewährleisten einen robusten und reproduzierbaren Herstellungsprozess mit gleichbleibender Qualität am Empfängerstandort. Dazu gehören
- Die Prozessentwicklung
- das Prozessdesign
- die Qualifizierung der Prozessleistung sowie
- die fortlaufende Prozessverifizierung
Beim Technologietransfer ist eine genaue Kenntnis der Beschaffenheit des Wirkstoffs sowie der Qualitätsmerkmale und der Formulierung, die sich durch die Stabilitätsprüfung ergeben können, von wesentlicher Bedeutung. Dies gilt vor allem dann, wenn Zulassungsstrategien in einigen Ländern spezifische Anforderungen für die kommerzielle Vermarktung aufweisen, die die Prozessqualifizierung beeinflussen können.
Regulatorische Anforderungen können ebenfalls Einfluss auf die Produktionsumgebung in Bezug auf z.B. Equipment oder Reinigungs- und Sterilisationsverfahren haben. Die Dokumentation des Transfers mit allen Protokollen, Berichten und Anweisungen muss allumfänglich sein.
Ein Transfer ist mit der Übergabe des qualifizierten Prozesses an die zuständigen Produktions- und Qualitätsbereiche für die kommerzielle Fertigung abgeschlossen.
Kompetenz und starkes Projektmanagement gefragt
In Anbetracht der Komplexität und des hohen Risikos verlassen sich viele Unternehmen oftmals auf die Expertise einer qualifizierten CDMO, die über weitreichende Erfahrung im Transfer von aseptischen Herstellungsprozessen und in der Anwendung moderner Forschungs- und Analysemethoden für die Prozessgestaltung und -entwicklung sowie umfangreiches Technologie Know-How verfügt.
Der Prozesstransfer gilt nur dann als gelungen, wenn der „Empfänger‘ das übertragene Produkt, den Prozess und die Methode anhand einer Reihe von vordefinierten Spezifikationen reproduzieren kann, die mit dem ursprünglichen „Sender“ vereinbart wurden. Der Erfolg eines solchen Projekts hängt daher oftmals maßgeblich von der Qualifikation und der Erfahrung des Projektmanagements und des Transferteams ab.
Um eine reibungslose Projektdurchführung zu gewährleisten, müssen die Rollen und Verantwortlichkeiten der Teammitglieder klar definiert sein. Zudem gilt es ein System zur Verfügung zu stellen, welches eine umfassende Kommunikation und Informationstransfer sicherstellt.
Doris Rottenbusch, Teamleiterin Technologie- und Prozesstransfer
Etabliertes Transferkonzept
Vetter bietet seinen Kunden ein ganzheitliches Konzept für den Transfer von der klinischen Abfüllung in Chicago (USA) und Rankweil (Österreich) zum kommerziellen Fill & Finish in Ravensburg.